1.Direkte Dissoziation und Adsorption von Wassermolekülen
An ungesättigten Metallstellen von Metalloxiden oder Halbleiteroxiden (wie Ti4+, Fe3+) adsorbieren Wassermoleküle zunächst in molekularer Form, gefolgt von der Spaltung der O-H-Bindung, was zu Brücken- oder terminalen Hydroxylgruppen (M-OH) und Oberflächenwasserstoffatomen führt. Die thermodynamische Triebkraft dieses Prozesses beruht auf der starken Lewis-Acidität der Metallionen, die die Dissoziation von Wassermolekülen erleichtert. Sowohl Experimente als auch DFT-Berechnungen deuten darauf hin, dass mit niedrigem Sauerstoffgehalt bedeckte Oberflächen zur Dissoziation und Adsorption neigen, während mit hohem Sauerstoffgehalt bedeckte Oberflächen zur Adsorption von Molekülen neigen.

2. Durch Sauerstoffleerstellen (VO) vermittelte Hydroxylbildung
Sauerstofffehlstellen an der Oberfläche liefern Elektronen, wodurch adsorbierte Wassermoleküle anfälliger für die Dissoziation werden. Nachdem Wassermoleküle an der Lücke adsorbiert sind, werden zwei Hydroxylgruppen erzeugt, von denen eine die Lücke füllt und die andere am angrenzenden Metall hängt. Dieser Mechanismus erklärt das Phänomen der signifikanten Zunahme der Hydroxyldichte unter reduzierenden oder hohen Temperaturbedingungen und steht in engem Zusammenhang mit Änderungen in der Koordinationszahl von Metallionen.

3.Wasserstoff oder Wasserstoffatomüberlauf
An der Metall/Oxid-Grenzfläche dissoziiert H2 auf dem Metall und bildet H ⁺/H ⁻, das dann durch Wasserstoffüberlauf an die Oberfläche des Metalloxids wandert und mit Oberflächensauerstoff Hydroxylgruppen bildet. Dieser Prozess wurde direkt in katalytischen Systemen wie der CO-Oxidation bei niedriger Temperatur beobachtet, und ein Wasserstoffüberlauf erhöhte die Geschwindigkeit der Erzeugung von Oberflächenhydroxylgruppen erheblich.

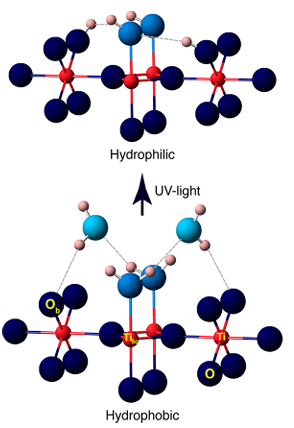
4.Photokatalytische/UV-induzierte Hydroxylbildung
UV-Licht regt Halbleiter wie TiO2 an, um Elektronen-Loch-Paare zu erzeugen, die Oberflächensauerstoffatome einfangen, um O⁻ zu bilden, und dann mit adsorbierten Wassermolekülen oder Hydroxylgruppen reagieren, um Oberflächen-OH⁻ zu erzeugen, begleitet von der Produktion von Hydroxylradikalen (· OH). Experimente haben gezeigt, dass UV-Bestrahlung zusätzliche Sauerstofffehlstellen auf der Oberfläche von TiO2 erzeugt, die weiter mit Wasser reagieren, um mehr Hydroxylgruppen zu erzeugen, was zu einer photoinduzierten Superhydrophilie führt.
5. Bildung von Hydroxylgruppen auf der Oberfläche von Aluminiumoxid
Auf der Oberfläche von Aluminiumoxid gibt es natürlicherweise eine kleine Menge Hydroxylgruppen. Wassermoleküle dissoziieren und adsorbieren an diesen Hydroxylgruppen, wodurch neues Al-OH entsteht. Während der Atomlagenabscheidung (ALD) unterliegt TMA (Trimethylaluminium) einem Koordinationsaustausch mit Oberflächenhydroxylgruppen, um Al-O-Al-Bindungen zu bilden und Methan freizusetzen; Anschließend reagiert der Wasserimpuls erneut mit Al-O-Bindungen, um Oberflächenhydroxylgruppen zu regenerieren und so eine zyklische Regenerierung der Hydroxylgruppen zu erreichen.

6.Oberflächenrekonstruktion – Metallmigration führt zur Hydroxylaggregation
Auf der Kristalloberfläche von Aluminiumoxid oder Titanoxid wandern lokale Metallionen (z. B. Al3+) bei hoher Temperatur oder hohem hydrochemischen Potenzial zu Oberflächenleerstellen und bilden Hydroxylcluster vom Typ Al (OH) 3 oder Ti (OH) 3. Dieser Umbau geht mit einer Gitterverzerrung einher, die die Adsorption von Hydroxylgruppen an benachbarte Wassermoleküle begünstigt und eine hochdichte Hydroxyl-Basisschicht bildet.

7. Der Hydrolysemechanismus von Hydroxylgruppen auf der Siliziumoberfläche
An der Si-O-Si-Brückenbindung verbinden sich Wassermoleküle mit der Silizium-Sauerstoffbindung durch synergistischen Protonen-Elektronentransfer und bilden Si-OH-Gruppen. Dieser Prozess ist besonders wichtig bei der Spannungskorrosion an der Rissspitze und der Oberflächenhydrolyse von Glas, und die Verstärkung der Si-OH-Zugschwingung wurde direkt durch experimentelle Infrarotspektroskopie beobachtet.
SAT NANO ist der beste Lieferant von Nanopulver und Mikropartikeln in China. Wir können Kohlenstoffnanoröhrenpulver anbieten, wie z
MWCNT-COOH,
MWCNT-OHWenn Sie Fragen haben, können Sie uns gerne unter sales03@satnano.com kontaktieren